Atomen
1. Atomen
Atomen zijn de bouwstenen van moleculen. Vanuit de eigenschappen van atomen kan ook veelal worden verklaard hoe deze samenkomen en bindingen vormen. Door de eigenschappen beter te begrijpen zal de bouw van een atoom worden behandeld. Vervolgens zullen enkele patronen worden weerlegd door de atomen in te delen in verschillende groepen. Vanuit deze indeling zal dieper worden gekeken naar bindingseigenschappen van atomen door verder in te gaan op de verdeling van elektronen in atomen. Tot slot zal de notatie van samengestelde atomen worden behandeld aan de hand van molecuulformules.
1. Bouw van een atoom
Atomen zijn opgebouwd uit protonen, neutronen en elektronen. De kern of nucleus van een atoom bestaat uit protonen en neutronen. De protonen in de kern geven een atoom een positieve lading. De positieve lading van een proton trekt een negatief geladen elektron aan. Deze elektronen bevinden zich rondom de kern in schillen. Deze (elektronen)schillen nemen ongeveer 99,9% van de ruimte van een atoom. De diameter van een atoom wordt dus bepaald door de diameter van de elektronenschillen. De schillen zijn wel honderdduizend (105) maal zo groot als de kern. Elektronen zijn nog weer kleiner dan protonen en neutronen. Atomen worden veelal vereenvoudigd weergegeven zoals te zien is in figuur 1. Deze schematische weergave weerspiegeld echter niet de realiteit, maar is een schematische weergave dat voor didactische (educatieve) doeleinden wordt gebruikt. Het weergeeft namelijk dat elektronen zich rondom de kern bevinden.
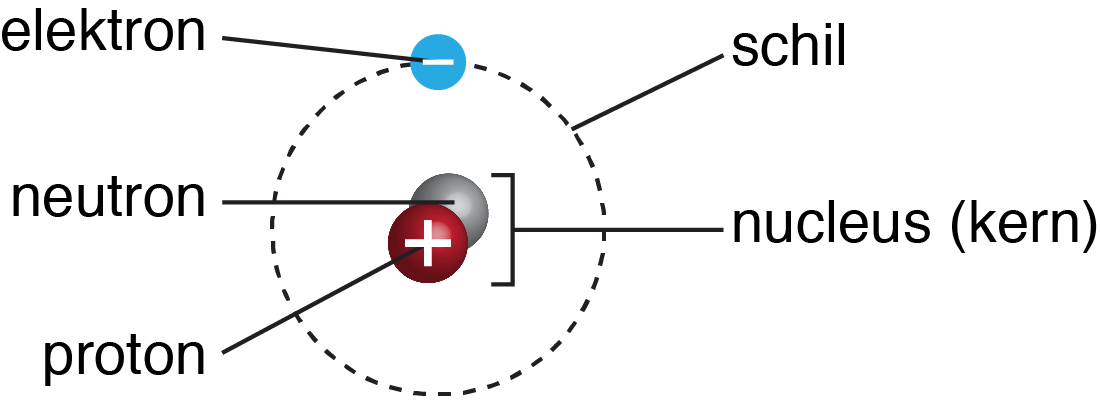
In het figuur is namelijk te zien dat de protonen in een kern een positieve lading dragen en de elektronen een negatieve lading. Een gelijke negatieve- en positieve lading heffen elkaar op en vormen een neutraal atoom dat bij elkaar wordt gehouden door elektromagnetische (straling) energie. Voor elke proton in de kern is dus een elektron nodig om de lading te neutraliseren. Toch is het niet zo dat alle atomen het meest stabiel zijn wanneer de lading neutraal is. Deze atomen komen in de natuur dan ook veelal voor als geladen deeltjes of ionen. \[\mathrm{\underbrace{X}_{atoom}\ \underbrace{X^{-}of\ X^{+}}_{ion}}\] Atomen hebben namelijk een neiging om alle elektronenschillen zoveel mogelijk op te vullen met elektronen. Om beter te begrijpen hoeveel schillen alle elementen (atomen) hebben is het goed terugkerende patronen te herkennen.
1.1. Atomen kunnen worden ingedeeld op periodiciteit
Atomen vertonen terugkerende eigenschappen. Daarom zijn alle atomen ingedeeld in een tabel genaamd het periodiek systeem der elementen (zie figuur 2).
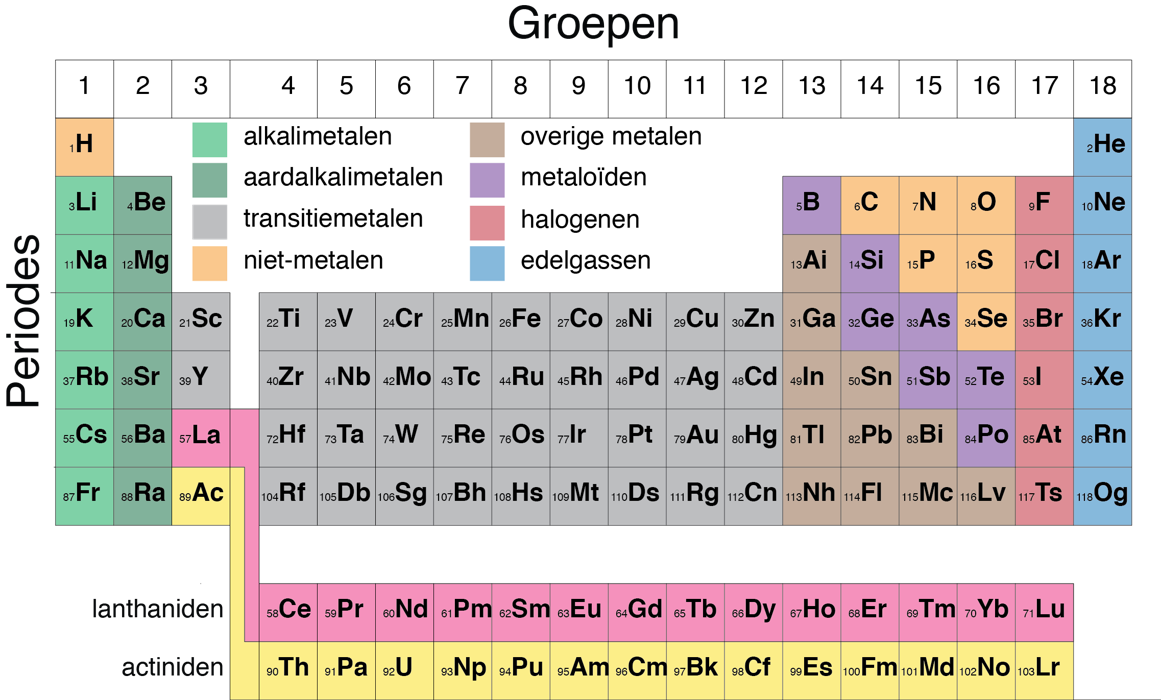
Het atoomnummer is gelijk aan het aantal protonen in de kern. Zo heeft waterstof maar een proton en dus is het atoomnummer ook 1. Helium heeft twee protonen, dus heeft atoomnummer 2, enzovoort.
ion = geladen deeltje
1.2. Ionen kunnen een positieve of negatieve lading hebben
Eerder werd benoemd dat de lading van een atoom komt door het verschil in aantal protonen en elektronen. Wanneer een atoom geladen is (ion) dan wordt alleen het aantal elektronen aangepast, niet het aantal protonen, want dit zou het element veranderen. Wanneer een atoom meerdere protonen bevat dan elektronen dan krijgt het een positieve lading en heet het ook wel een kation. Wanneer het aantal elektronen de meerderheid vormen dan krijgt het atoom een negatieve lading en heet het een anion. Neem waterstof als voorbeeld, deze kan een positieve lading hebben en een negatieve lading. Dus de ladingen +1 en −1 in waterstof kunnen we dan weergeven als H+ en H− (zie figuur 3).
kation = positief
anion = negatief

Hier zijn geen getallen voor de lading geplaatst, want deze hoeven niet worden te worden opgeschreven wanneer de lading +/−1 is, wanneer de lading groter is dan één dan wordt het getal wel achter de lading vermeld. Zuurstof heeft bijvoorbeeld altijd twee negatieve ladingen, dit wordt dan geschreven al O2−. In andere woorden, de lading zegt dat er twee elektronen in overschot zijn.
Voorbeeld 1. Toewijzen van protonen en elektronen
Geef het aantal protonen en elektronen van O2, O2− en OH−. We beginnen met het opzoeken van de atoomnummers van de elementen. We zien twee atomen; waterstof (atoomnr. 1) en zuurstof (atoomnr. 8). Het atoomnummer is gelijk aan het aantal protonen, dus deze hebben we opgelost. We zien zowel een molecuul (O2) als ionen (OH− en O2−). Bij moleculen is het aantal elektronen gelijk aan het aantal protonen. Deze worden door covalente bindingen gedeeld tussen atomen. Afhankelijk van de lading moeten er nog elektronen worden toegevoegd of worden verwijderd. In dit geval zien we dat er elektronen bij komen. Een elektron voor OH− en twee elektronen voor O2−. Zie onderstaande tabel voor de samenvatting.
| Aantal protonen | Aantal elektronen | |
| O2 | 8+8=16 | 16 |
| OH− | 8+1=9 | 9+1=10 |
| O2− | 8 | 8+2=10 |
1.3. Neutronen dragen bij aan de stabiliteit van de nucleus
Naast de protonen dat de kern een positieve lading geeft bestaat deze ook uit neutronen. Neutronen hebben geen lading en dragen dus ook niet bij aan de lading van het atoom zoals dat wel te zien is bij protonen en elektronen. De kern kan dan ook verschillende aantal neutronen hebben. Atomen met een verschillende aantal neutronen heten isotopen
Let op: het massagetal is niet gelijk aan de atoommassa(!)
Voorbeeld 2. Isotopen van waterstof
Waterstof bevat een proton en wordt dan ook wel geschreven als 1H. Waterstof met een extra neutron wordt ook wel deuterium genoemd en wordt dan geschreven als 2H en waterstof met twee extra neutronen (tritium) als 3H (zie figuur 4).
Het aantal neutronen is te bepalen door het verschil te berekenen tussen de waarde in superscript en het atoomnummer. Waterstof heeft een atoomnummer 1, en bij 3H zien we dat er drie protonen en neutronen zijn, dus het aantal neutronen is dan 3−1=2. Voor 2H doen we hetzelfde en zien we dat we 2−1=1 neutron hebben.

Het aantal neutronen in de nucleus heeft invloed op de stabiliteit van het atoom. Zo is bijvoorbeeld lood met 125 neutronen erg onstabiel, maar lood met 206 neutronen juist erg stabiel. Bij atomen met een erg onstabiele kern kan deze uit elkaar vallen. Zo kunnen neutronen en protonen van de kern worden afgesplitst. In het geval de isotoop spontaan uit elkaar valt wordt er gesproken over radioactief verval.
Voorbeeld 3. Radioactieve bananen?
Bananen bevatten een kleine portie radioactieve kalium. Het meest voorkomende isotoop van kalium is kalium-39. Het radioactieve kalium dat in bananen voorkomt is kalium-40. Het komt echter in dusdanig kleine hoeveelheden voor dat dit niet schadelijk is voor de gezondheid.
Wat is het verschil in protonen en neutronen?
Gezien twee dezelfde elementen met elkaar worden vergeleken is er geen verschil in protonen. We kunnen dus afleiden van het massagetal dat er een verschil is van één neutron tussen kalium-39 \(\mathrm{ (\ {_{19}^{39}}K)} \) en kalium 40 \(\mathrm{ (\ {_{19}^{40}}K) }\).
| a. Lithium |
Lithium is te vinden in de eerste groep, dus behoort het tot de alkalimetalen.
| b. Koolstof |
Koolstof behoort tot de niet-metalen.
| c. Boor |
Boor behoort tot de metalloïden. Technisch gezien behoort boor ook tot de niet-metalen, maar omdat het eigenschappen heeft van metalen wordt het ook wel een metalloïde genoemd.
| d. Fluor |
Fluor behoort tot de halogenen.
| a. K |
kalium
| b. Fe |
ijzer
| c. N |
stikstof
| d. Br |
broom
| e. Mg |
Magnesium
| ele. | protonen | elektronen | |
| a. O2− | |||
| b. He | |||
| c. Ni3+ | |||
| d. P+ | |||
| e. Hg2+ |
De extra neutronen in de kern geeft de kern wel meer massa, maar de kernen minder dan 0,1% van het volume innemen verandert er vrijwel niets aan het volume.
| Element | Protonen | Neutronen | Elektronen | atoom/ion | |
| 208Pb |
|
||||
| 110Cd2+ |
|
||||
| 13C4− |
|
||||
| 39K+ |
|
||||
| 197Au3+ |
|
