Atomen
2. Elektronenconfiguraties
Zoals in de vorige sectie al kort werd genoemd omgeven elektronen zich rondom de kern in schillen. Doordat de verschillende ladingen van de protonen en elektronen elkaar aantrekken willen elektronen zich zo dicht mogelijk bij de kern bevinden. De elektronen bevinden zich in schillen en komen steeds verder van de kern af te liggen na mate de schillen worden gevuld. Elk elektronenschil kan namelijk tot een maximaal aantal aan elektronen worden opgevuld. De verdeling van elektronen in de schillen heet de elektronenconfiguraties. De configuraties zijn in de Binas tabel 99 weergegeven. De configuraties worden veelal schematisch weergegeven met het Bohr model dat is vernoemd naar de natuurkundige Niels Bohr.
2.1. Het Bohr model weergeeft de elektron configuratie
In deze weergave wordt de nucleus in het midden getekend. De elektronen worden opgevuld volgens de aufbau (opbouw) principe dat luidt dat elektronen eerst de schillen met de laagste energie opvullen. In andere woorden dit zijn de schillen die het dichtst bij de kern gelegen zijn. Zo kan het meest dichtstbijzijnde schil de K-schil maximaal twee elektronen dragen. Dus de capaciteit van de K-schil is twee elektronen. Dit kan dan als volgt worden weergeven.
De volgende schil is de L-schil en heeft een capaciteit van acht elektronen. Bij het tekenen wordt eerst de K-schil opgevuld, daarna wordt de L-schil opgevuld.
Daarna hebben we nog de M-schil dat een capaciteit heeft van 18 elektronen. Alleen gebeurt bij het opvullen van de M-schil iets bijzonders. Deze wordt niet direct opgevuld. Na tien elektronen worden twee elektronen opgevuld in de N-schil voordat deze verder wordt opgevuld. Een compleet gevulde M-schil ziet er dan als volgt uit.
Daarnaast zijn er nog de N, O, P en Q schillen met allemaal een capaciteit van 32 elektronen per schil. Voor de bovenste twee periodes (rijen) in het periodiek systeem is het aantal elektronen gelijk aan het aantal elementen in de periode. De verdeling van elektronen over de schillen heet de elektronenconfiguratie. Een overzicht van de schillen zijn weergegeven in tabel 1, daarnaast zijn deze schillen te vinden in Binas tabel 23.
| schil | K | L | M | N |
| capaciteit | 2 | 8 | 18 | 32 |
| Totaal aantal elektronen | 2 | 10 | 28 | 50 |
Voorbeeld 4. Tekenen van atomen
Teken de atomen volgens het Bohr model van een zwavel (S) atoom.
Zwavel bevindt zich in de derde periode met atoomnr. 16. We vullen dus de K-, L- en M schil. Teken eerst de kern met schillen.
Om de elektronen configuratie kloppen te maken kijken we eerst naar het aantal protonen, dus het atoomnummer en de lading. In de opgave is geen lading opgegeven. Dus het aantal elektronen is dan gelijk aan het aantal protonen. De K- en L schil worden volledig verzadigd met respectievelijk twee en acht elektronen en de M schil zal nog zes elektronen dragen. De configuratie is dus 2,8,6 elektronen.
Dit is dan hoe een model kan worden weergegeven. Let op: de verdeling van elektronen zijn niet strikt. Het belangrijkste is het besef dat de juiste schillen met de juiste hoeveelheid elektronen worden opgevuld. Teken het zo dat het in ieder geval overzichtelijk is.
Opmerking: Hoewel het niet verplicht is om het symbool te tekenen in de kern kan dit het wel duidelijker maken, vooral wanneer verschillende atomen worden getekend.
Voorbeeld 5. Elektronenconfiguratie schrijven
a. Geef de elektronenconfiguratie van Be2+.
Beryllium heeft atoomnummer 4 en omdat de het twee positieve ladingen verliest het twee elektronen, dus het heeft dan nog twee elektronen over. Alleen de K-schil wordt gevuld, dus de configuratie is dan Be: 2,2.
b. Geef de elektronenconfiguratie van Si.
Silicium heeft atoomnummer 14 en omdat de lading niet is gespecificeerd is het aantal elektronen gelijk aan het atoomnummer. Met 14 elektronen worden de K-, en L-schil volledig verzadigd. De buitenste schil wordt dus de M-schil. De configuratie is dan Si: 2,8,4.
2.2. Schillen bestaan weer uit subschillen
De elektronenschillen zijn gelijk aan de periodes in het periodiek systeem. Toch valt het op dat voor de eerste twee rijen nog wel te zien is dat het aantal elementen in de periode gelijk is aan het aantal elektronen per schil. Maar vanaf de derde periode begint het al op te vallen dat er een afwijking is van de capaciteit en het aantal elementen in de periode. De capaciteit van de M-schil is 18 elektronen, maar er zijn 10 elementen in de derde periode. Dit heeft te maken doordat alle schillen weer bestaan uit subschillen of orbitalen. Het s-orbitaal, draagt 2 elektronen. De K-schil bevat dan ook maar een s-subschil. De subschillen zijn:
- - Het s-orbitaal, draagt 2 elektronen (s2);
- - Het p-orbitaal, draagt 6 elektronen (p6);
- - Het d-orbitaal, draagt 10 elektronen (d10), vooral te zien bij transitiemetalen (overgangsmetalen);
- - Het f-obitaal, draagt 14 elektronen (f14), is te zien in actiniden en lantiniden.
De L-schil bevat een s-, en p-orbitaal. Met deze informatie kan tabel 1 worden geüpdatet.
| schil | K | L | M | N |
| capaciteit | 2 | 8 | 18 | 32 |
| Subschillen (s,p,d) | 1s2 | 2s2, 2p6 | 3s2, 3p6, 3d10 | 4s2, 4p6, 4d10, 4f14 |
| Totaal aantal elektronen | 2 | 10 | 28 | 50 |
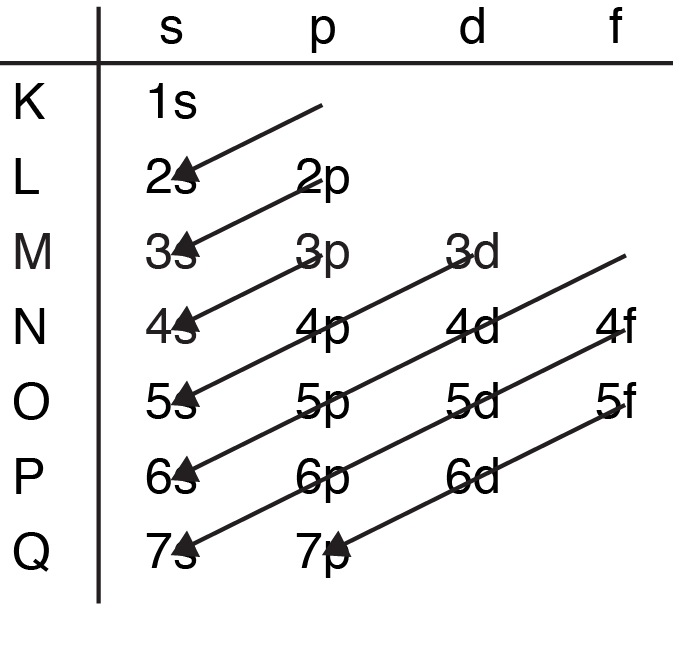
Eerder werd benoemd dat na 10 elektronen in de M-schil twee elektronen worden toegevoegd aan de N-schil voordat de M-schil verder wordt opgevuld. De reden is omdat het 4s orbitaal een lagere energie heeft dan de 3d orbitaal. Welke schillen als eerst wordt opgevuld kan met onderstaande schema worden weergegeven. De volgorde waarin de subschillen worden opgevuld wordt weergegeven met de pijlen. Zo is te zien dat bij de K- en L-schil niets gebeurt met de volgorde, maar vanaf de M-schil verandert de volgorde waarom op schillen worden opgevuld. Na de 3p schil, vult eerst de 4s schil, pas daarna vult de 3d schil. Dus het is meer correct om de subschillen op te vullen dan alleen de schillen.
Voorbeeld 6. Complexere configuraties
Geef de elektronenconfiguratie van Cr en teken het Bohr atoom.
Chroom heeft atoomnummer 24. De lading is in dit geval niet gespecificeerd, dus het aantal elektronen is gelijk aan het atoomnummer. De K-, en L-schil zijn volledig verzadigd. Dan is er nog ruimte voor 14 elektronen. Nu is het verleidelijk om 14 elektronen in de M-schil te tekenen, maar dit is niet correct(!)
Na acht elektronen worden twee elektronen in de M schil worden twee toegevoegd aan de N schil. Gezien de M-schil een capaciteit heeft van 18 elektronen wordt dit de buitenste schil en worde deze niet volledig opgevuld. De configuratie is dan Cr:2,8,13,1.
Voorbeeld 7. Configuraties met subschillen
Geef de elektronen configuraties van de stoffen.
a. Stikstof
Stikstof heeft als atoomnummer 7, de K-schil is volledig gevuld en de L-schil is nog incompleet. De K-schil bestaat uit de subschil 1s. De L-schil bestaat uit de subschillen 2s en 2p. Het aantal elektronen per subschil wordt aangegeven met een superscript achter het subschil. De configuratie is dus
\[\mathrm{N:1s^2,\ 2s^2,\ 2p^3}\]
b. Scandium
Volgens de aufbau principe worden de schillen met de laagste energie eerste gevuld. De 4s orbitaal wordt eerst gevuld voordat de 3d orbitaal wordt gevuld met elektronen.
\[\mathrm{Sc:\ 1s^2,\ 2s^2,\ 2p^6,\ 3s^2,\ 3p^6,\ 4s^2,\ 3d^1}\]
2.3. Verzadigde subschillen zijn het meest stabiel
Alle atomen in de laatste groep, de edelgassen hebben alle subschillen volledig verzadigd met elektronen. De naam edelgassen hebben de naam ook hieraan te danken. Doordat alle banen verzadigd zijn met elektronen zijn deze erg stabiel en reageren nauwelijks, deze stoffen zijn dus inert. Alle andere atomen willen ook de schillen zo volledig mogelijk vullen totdat zij de zogenaamde edelgasconfiguratie hebben bereikt. Deze edelgasconfiguratie kan ook worden gebruikt om de elektronenconfiguraties weer te geven van atomen. Zo kan het aantal schillen dat wordt gevuld door de egelgassen worden vervangen met het symbool van het edelgas. Vervolgens hoeft alleen het ontbrekende aantal schillen worden ingevoerd om de configuratie van het element volledig te maken.
| Extra elektronen | Elektronenconfiguratie | ||
| volledig | verkort | ||
| He | 2 (K-schil) | \(\mathrm{1s^2}\) | \(\mathrm{1s^2}\) |
| Ne | 8 (L-schil) | \(\mathrm{1s^2,\ 2s^2,\ 2p^6}\) | \(\mathrm{\left[He\right]2s^2,\ 2p^6}\) |
| Ar | 8 (M-schil) | \(\mathrm{1s^2,\ 2s^2,\ 2p^6,\ 3s^2,\ 3p^6}\) | \(\mathrm{\left[Ne\right]3s^2,\ 3p^6}\) |
| Kr | 18 (M-, N-schil) | \(\mathrm{1s^2,\ 2s^2,\ 2p^6,\ 3s^2,\ 3p^6,4s^2,3d^{10},4p^6}\) | \(\mathrm{\left[Ar\right]4s^2,3d^{10},4p^6}\) |
Voorbeeld 7.2. – Herschrijven van configuraties
In het vorige voorbeeld werd de configuraties van stikstof en scandium geschreven. Deze kunnen als volgt worden herschreven. \[\mathrm{N:\ \underbrace{1s^2}_{He},\ 2s^2,\ 2p^3\rightarrow N:[He]2s^2,2p^3}\] \[\mathrm{Sc:\ \underbrace{1s^2,\ 2s^2,\ 2p^6,\ 3s^2,\ 3p^6}_{Ar},\ 4s^2,\ 3d^1\rightarrow Sc:[Ar]4s^2,3d^1}\]
De edelgasconfiguratie van atomen kan worden afgeleid van de positie van het atoom in het periodiek systeem ten opzichte van het meest dichtstbijzijnde edelgas. Het verschil in atoomnummer van het atoom en het edelgas is gelijk aan het aantal elektronen dat het atoom moet opnemen of afstaan om de buitenste schil volledig te vullen. Dit heeft als handigheid dat voor de eerste twee periodes in het periodiek systeem de buitenste schillen direct kunnen worden afgelezen door naar het edelgas te kijken in de elektronenconfiguratie.
De elektronen in de buitenste s-, en p-subschillen heten valentie-elektronen. Deze valentie elektronen bepalen in grote mate de bindingseigenschappen van atomen. De elektronen in de d-subschillen variëren in bindingseigenschappen. Wanneer de subschillen worden weergegeven dan worden de valentie elektronen weergegeven achter het edelgas.
Voorbeeld 7.3. – Valentie-elektronen
Met de configuratie van stikstof en scandium die in de vorige voorbeelden zijn gegeven zijn de valentie elektronen weergegeven. Wat zijn de valentie elektronen en valentie banen? \[\mathrm{N:[He]\underbrace{2s^2,2p^3}_{valentie elektronen}}\] Stikstof heeft dus vijf valentie elektronen. Nog drie elektronen zijn nodig, dus er zijn drie valentie banen beschikbaar. \[\mathrm{Sc:\left[Ar\right]\underbrace{4s^2,3d^1}_{valentieelektronen}}\] Scandium heeft dus drie valentie elektronen. In theorie heeft het nog 15 valentiebanen, maar scandium zal eerder de elektronen afstaan. Toelichting: Vergelijk maar eens de configuratie van Krypton. In de Binas zijn de configuratie weergegeven links onderin bij elk element. De configuratie van krypton is \[\mathrm{Kr:\left[Ar\right]4s^2,3d^{10},4p^6}\] en heeft dus 2+10+6=18 elektronen in de valentie baan.
Test je kennis
a. F
b. O…C…O
c. H…Cl
d. Ca…S
Kijk naar het aantal valentie banen/elektronen van elk element. a. 1,2; H-N=O b. 2,2; O=C=O c. 1; H-Cl d. 2; Ca=S
Atomen willen altijd in de edelgasconfiguratie verkeren. In andere woorden, ze willen altijd de elektronenschil zo volledig mogelijk verzadigen.
Voorbeeld: S:2,8,6 (Zie voorbeeld 4)
a. C
b. B
c. Al
d. Ar
De elektronenconfiguraties zijn gegeven in Binas tabel 99, deze staan links onderin elk element en kunnen direct worden overgenomen.
a. C:2,4
b. B:2,3
c. Al:2,8,3
d. Ar:2,8,18
H+
a. Een van de elementen in het figuur zijn niet juist weergegeven. Verklaar welk element dit is en waarom.

Element C, De twee elektronen in de N-schil ontbreekt.
Het aantal protonen is gelijk aan het atoomnummer.
A. De lading is neutraal. Dus het aantal elektronen is gelijk aan het atoomnummer en dit is dus helium (He).
B. atoomnummer=10+1=11, dus dit is natrium (Na).
C. atoomnummer=28−2=26, dus dit is ijzer (Fe).
Wanneer het gecorrigeerde element is gebruikt, dan komen er nog twee elektronen bij. Dan zou het element nikkel (Ni) zijn.
C
Let op, de edelgas configuratie kan worden gebruikt om de notaties makkelijker te schrijven. Echter, het is niet fout wanneer je het volledig uitschrijft, vandaar dat beide notaties zijn weergegeven. \[\mathrm{C:\ \underbrace{1s^{2}}_{He},\ 2s^{2},\ 2p^{2}\rightarrow C:[He]2s^{2},2p^{2}}\]
\[\mathrm{F:\ \underbrace{1s^{2}}_{He},\ 2s^{2},\ 2p^{5}\rightarrow F:[He]2s^{2},2p^{5}}\]
\[\mathrm{Si:\ \underbrace{1s^{2},\ 2s^{2},\ 2p^{6}}_{Ne},3s^{2}, 3p^{2}\rightarrow Si:[Ne]3s^{2},3p^{2}}\]
