Chemische Bindingen
2. Type bindingen
Atomen kunnen niet zomaar een elektron opnemen, deze zijn niet los in de ruimte aanwezig. Er zullen andere atomen zijn die het elektron ook aantrekken. Toch kunnen atomen onderling wel atomen uitwisselen of juist gebruiken om stabiele bindingen te gebruiken. Door te binden aan andere atomen kunnen deze schillen namelijk ook worden opgevuld. De manieren waarom atomen bindingen met elkaar kunnen aangaan kunnen ruwweg in drie klassen worden verdeeld:
- - Molecuulbindingen (Covalente binding)
- - Ion binding
- - Metaal binding
2.1. Elektronen worden gedeeld in molecuulbindingen
De sterkste type binding ontstaat wanneer valentie elektronen worden gedeeld tussen twee atomen en heet dan ook een covalente binding of molecuulbinding en deze stoffen heten dan ook wel moleculaire stoffen. In moleculaire stoffen delen elektronen de valentie elektronen door overlap in de elektronschillen. Zo wordt geen elektron afgestaan of opgenomen, maar door de overlap bevindt het elektron zich in de schillen van beide atomen. Dus beide atomen krijgen er een elektron bij waardoor de schillen worden gevuld zonder dat de elementen een elektron af te staan. Door bindingen met andere atomen aan te gaan kan de edelgasconfiguratie ook worden bereikt.
co- = gezamelijk
valent = valentie
Voorbeeld 4. Covalente bindingen in water
Zuurstof heeft nog twee elektronen nodig om de L-schil volledig op te vullen. Waterstof heeft nog één elektron nodig om de K-schil volledig te vullen. Door de elektronen te delen (zie het figuur rechts) heeft waterstof en zuurstof respectievelijk twee en tien elektronen.
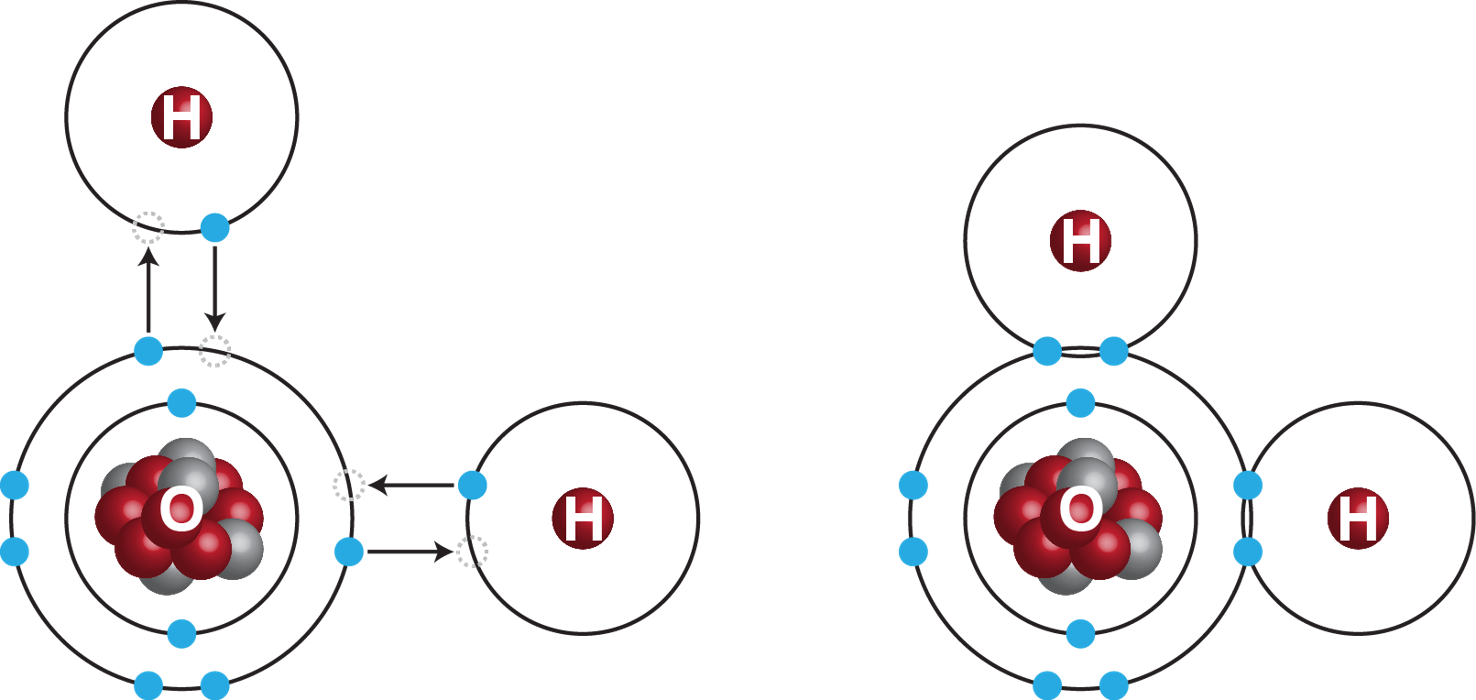
Omdat in moleculaire stoffen geen elektronen direct wordt uitgewisseld is er ook geen vrije beweging van elektronen. Deze beperkte beweging maken moleculaire stoffen ook slechte geleider van een elektrische stroom. Dit is kenmerkend voor de niet-metalen die dan ook de grootste groep vormen van atomen die een covalente binding aangaan.
2.2. Metalen kunnen elektronen opnemen of afstaan
In tegenstelling tot de niet metalen kunnen metalen wel elektronen afstaan of opnemen. Dit heeft bijvoorbeeld te maken dat atomen van metalen een positieve lading kunnen hebben. Zo is bijvoorbeeld bij de alkalimetalen (eerste groep) te zien dat deze altijd een positieve lading hebben. Deze zullen dus een elektron afstaan wanneer het mogelijk is, maar omdat de positieve lading van het ion ook weer elektronen aantrekt kunnen deze ook weer elektronen opnemen. Daarnaast hebben metalen ook de eigenschap dat deze een ander type binding kunnen aangaan op basis van ladingsverschil. Het is te vergelijken met twee magneten die elkaar aantrekken. Deze aantrekkingskracht is niet zo sterk als een covalente binding, maar geeft het wel het vermogen om bijvoorbeeld roosters te vormen. Echter, de eigenschappen van deze bindingen hangen af van waar het metaal een binding vormt met een ander metaal (metaalbinding) of een niet-metaal (ion binding).
metaalbindingen
Metaalbindingen worden gevormd wanneer twee metalen aan elkaar binden. Vele metalen kunnen op deze manier onderling binden en kunnen een metaalrooster vormen. In een metaalrooster kunnen elektronen vrijuit bewegen door de positieve ladingen van de metalen (zie figuur 1).
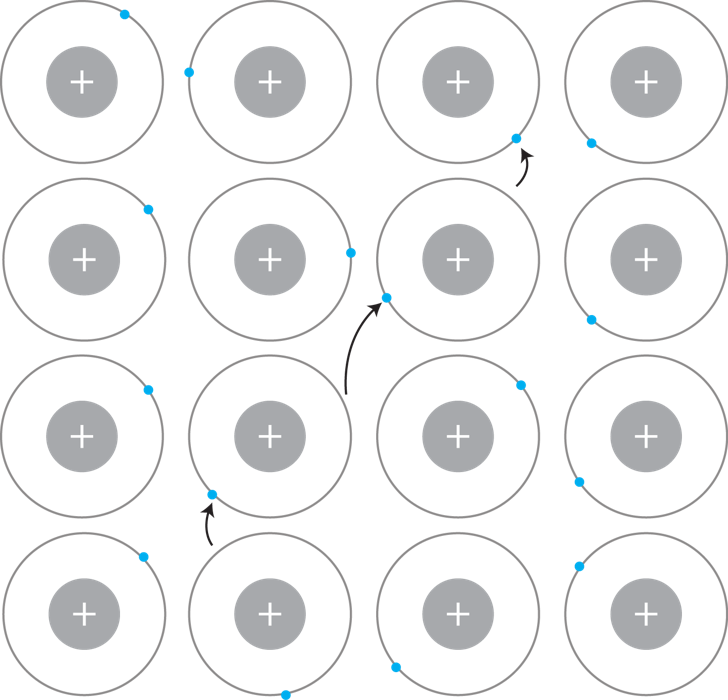
De positieve ladingen van de metalen zorgen ervoor dat de kernen wel elektronen blijven aantrekken, maar deze kunnen ook makkelijk worden afgestaan. Hier zijn echter verschillende redenen voor. Bij de alkalimetalen en aardalkalimetalen komt dit bijvoorbeeld om deze atomen graag een elektron afstaan, de S-schil is wel een schil dat dichter bij de kern gelegen is en daardoor is er ook meer energie nodig om het elektron af te nemen. Bij de transitiemetalen (overgangsmetalen) komt dit doordat de d-subschil groot is, waardoor de elektronen verder dan de kernen afstaan en dus ook minder hard worden aangetrokken door de kern. Dit zorgt er dan ook voor dat de elektronen snellen van baan zullen verspringen wanneer een elektrische spanning wordt uitgeoefend.
Wanneer een rooster wordt gevormd uit verschillende metalen wordt dit een legering genoemd. Het verschil in deeltjesgrootte in een rooster verandert ook de eigenschappen van het gevormde rooster. Eigenschappen van metalen zijn weergegeven in Binas tabel 9.
Voorbeeld 5. Staal
Een rooster dat alleen is opgebouwd uit ijzer is niet zo hard. Maar wanneer een kleine hoeveelheid koolstof wordt toegevoegd aan het rooster neemt de stevigheid aanzienlijk toe. Echter, wanneer te veel koolstof wordt toegevoegd aan het rooster verliest de flexibiliteit en zal het sneller breken. Omdat hele kleine hoeveelheden koolstof wordt toegevoegd verliest ook niet de eigenschappen van een metaalrooster, zoals het geleiden van een stroom.
Ionbindingen
Wanneer metalen gebonden zijn aan een niet-metaal wordt deze bewegingsvrijheid van een elektron echter beperkt. Deze metaal en niet-metaal bindingen vormen zouten en worden bij elkaar gehouden door ion bindingen. Deze type bindingen onderscheiden zich van metaalbindingen doordat de niet-metaal niet zo snel een elektron zal afstaan en juist naar zich toe trekt. Zo hebben immers de halogenen nog een elektron nodig om de schil volledig te verzadigen met elektronen. Wanneer deze in contact komt met een metaal dat wel een elektron kan afstaan zal de halogeen ook direct een elektron afpakken. Hierdoor ontstaat polarisatie, er is nu namelijk een positief deel (metaal) en een negatief deel (niet-metaal). Door het ladingsverschil worden de tegenpolen tot elkaar aangetrokken waardoor een zout wordt gevormd. Dit is te vergelijken met een magneet dat elkaar aantrekt. Alleen worden hier de polen niet aangetrokken door een magnetisch veld, maar door een elektrisch veld.
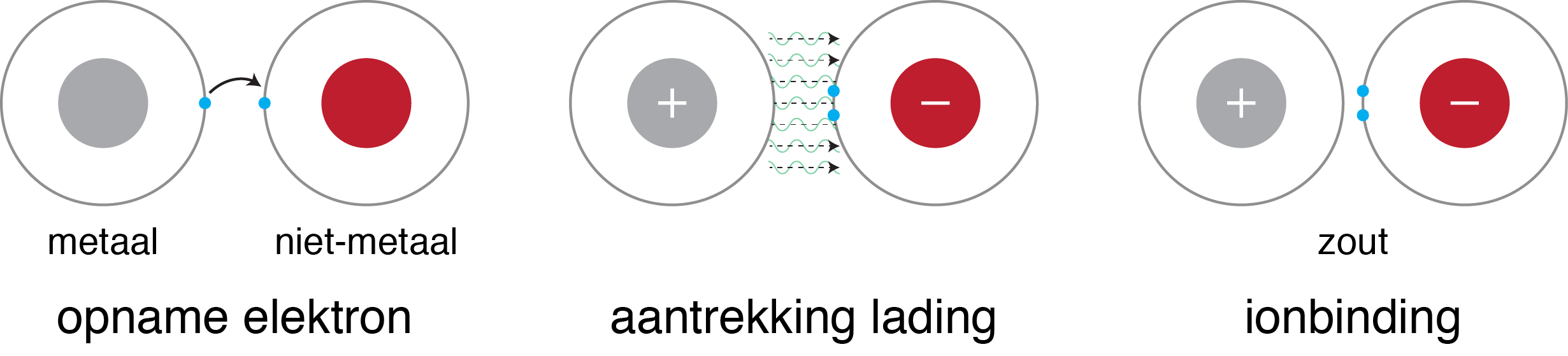
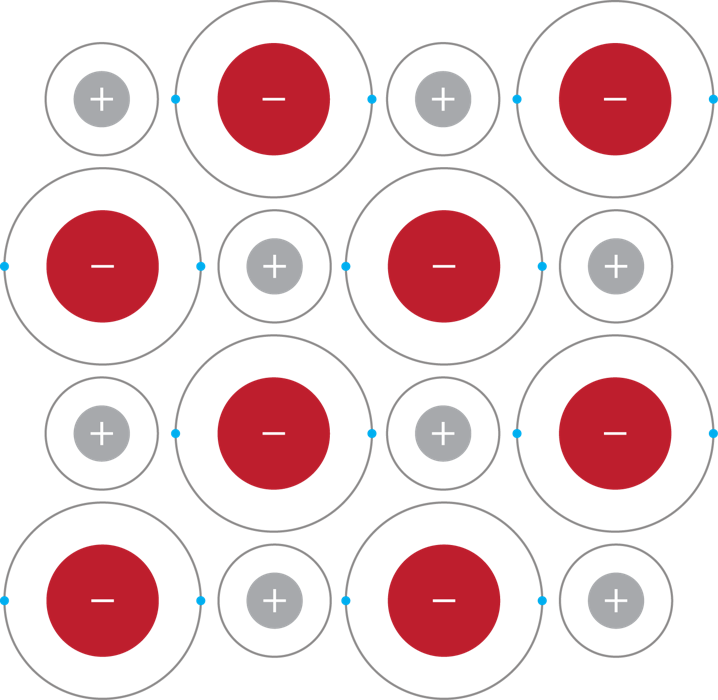
Deze aantrekking zorgt er ook voor dat ook bij zouten roosters worden gevormd, namelijk een ionrooster (zie onderstaand figuur. In tegenstelling tot een metaalrooster is een ionrooster geen goede geleider van een elektrische stroom door de beperkte bewegingsvrijheid van de elektronen in het rooster. Wanneer het zout wordt opgelost is het echter wel een goede geleider van een elektrische stroom. Dit heeft te maken met dat de zouten worden geïoniseerd. De deeltjes dat bij elkaar wordt gehouden door ion-bindingen worden gesplitst in twee geladen deeltjes. Dit betekent dat nu positief geladen deeltjes in de oplossing aanwezig zijn die geleiding van een stroom mogelijk maken.
Voorbeeld 6. Keukenzout
De meest bekende voorbeeld is misschien wel keukenzout (NaCl). Natrium behoort tot de alkalimetalen en zal een elektron afstaan en de halogeen chloor zal het elektron opnemen. Alleen natrium is in dit geval een metaal en de binding dat wordt gevormd is dus een ion binding. De ionrooster vormen de kleine korrels zout. Wanneer deze worden toegevoegd aan een glas water zal het rooster breken omdat het rooster wordt geïoniseerd. Hierbij wordt NaCl opgesplitst in Na+ en Cl−.
Waar metaalroosters buigbaar zijn is die niet het geval in de meeste ionroosters. Dit heeft te maken door hoe de roosters zijn opgebouwd. Wanneer de metalen in een metaalrooster verschuiven heeft dit niet beslist veel invloed, maar het verschuiven van de atomen in een ionrooster wordt tegengewerkt door de verschillende ladingen die het rooster bij elkaar houdt. Als een rij zou verschuiven zouden twee deeltjes met gelijke ladingen tegenover elkaar komen te liggen die elkaar afstoten. Daardoor zal een ionrooster ook sneller breken.
Alle type bindingen zijn samengevat in onderstaande tabel.
| Soort binding | Manier van binding | Kracht binding | Ioniseert in oplossing | Metaal (m)/ niet metaal (n) | Mate van elektrische geleiding |
| Covalent (molecuul) |
Delen van (valentie)elektronen | Sterkst | Nee | n-n | Geleid geen stroom |
| Ion | Aantrekking van tegengestelde ladingen | Minder sterk | Ja | m-n | Alleen in oplossing |
| Metaal | Aantrekking van tegengestelde ladingen | Minder sterk | Ja/nee | m-m | Als vaste stof of in oplossing |
Test je kennis
Bij natriumfluoride (NaF) hebben we een metaal en een halogeen dat een ion-binding vormt en dus een zout is. Bij waterstoffluoride (HF) hebben we een niet-metaal en een halogeen dat dus geen zout vormt.
KOH
Moleculaire stoffen worden bij elkaar gehouden door covalente bindingen. Deze zijn sterker dan de krachten die op de stof wordt uitgeoefend door water.
