Chemische Reacties
1. Reacties
Deeltjes in een vloeistof of gas zijn continu in beweging. In een ruimte waar allerlei deeltjes willekeurig door elkaar heen bewegen zullen uiteindelijk botsingen ontstaan. Botsingen tussen atomen en moleculen vinden ook voortdurend plaats, alleen is de ene botsing harder dan de ander. Wanneer een botsing hard genoeg is kan dit leiden tot een verandering van de samenstelling van de botsende moleculen. Zo kan een botsing leiden tot het verbreken van bindingen waardoor het molecuul uit elkaar valt, maar uit deze botsing kunnen ook juist nieuwe bindingen ontstaan. Wanneer de samenstelling van de botsende deeltjes (moleculen) verandert als gevolg van de botsing dan heet deze botsing een effectieve botsing. De deeltjes in een effectieve botsing reageren dan met elkaar.
De moleculen die met elkaar reageren heten ook wel de reactanten of beginstoffen. De reactanten zullen tijdens een chemische reactie elektronen uitwisselen dat zal leiden tot de verandering. Het resultaat van deze uitwisseling van elektronen is dat een nieuwe stof of (reactie)product wordt gevormd. Deze reactie kan dan in een vergelijking, een reactievergelijking, worden geschreven.

Deze reactie kan worden gelezen als: wanneer deze reactanten een effectieve botsing ondergaan dan worden deze producten gevormd. Deze producten zijn afhankelijk van de verandering die optreedt met de reactanten.
De afbeelding laat echter nog iets zien, tijdens een reactie wordt niet alleen een product gevormd maar komt ook energie vrij. De eerste wet van energiebehoud stelt namelijk dat energie niet verloren gaat, maar alleen van vorm verandert. Niet alle (kinetische) energie wordt bij een botsing overgedragen, dus blijft een deel van de energie over. Deze energie komt vrij als stralingsenergie of warmte. Deze andere vorm van energie dat vrijkomt bij een reactie is in de meeste gevallen warmte. Daarom worden chemische reacties waarbij energie vrijkomt ook wel exotherm genoemd. Wanneer energie juist nodig is om een reactie te laten verlopen wordt deze endotherm genoemd. Bij een endotherme reactie wordt energie in het systeem gestopt om een reactie te laten verlopen dat anders ongunstig zou zijn. Ongunstig wil zeggen dat het gevormde product minder stabiel is dan de reactanten. Het verloop van een reactie kan worden gevisualiseerd aan de hand van een energiediagram.
Exo – buiten, buitenaf
Endo – binnen, binnenuit
Therm – (verandering) temperatuur
1.1. Energiediagrammen weergeven het verloop van een reactie
In een energiediagram wordt het verloop van de reactie weergegeven op de horizontale as wordt weergegeven en de energie op de verticale as. Deze diagrammen zijn eerder schetsen en zijn dus niet exacte weergaven van een reactie. Een voorbeeld van een exotherme reactie is weergegeven in figuur 1.
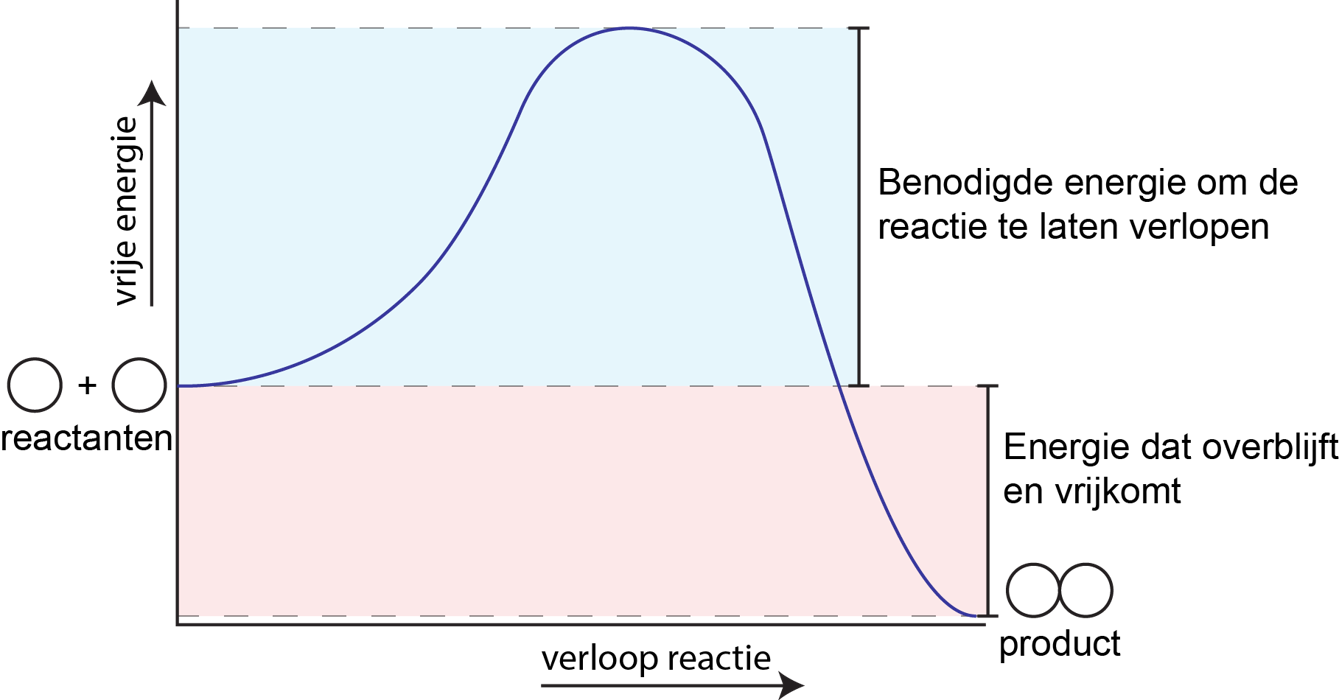
Het diagram begint met de reactanten links en eindigt met de producten rechts. Het valt op dat de reactanten en de producten zijn gescheiden door een drempel. De hoogte van deze drempel is de activeringsenergie en is de energie dat nodig is om een reactie te laten verlopen. Hoe hoger de drempel, hoe meer energie nodig is om een reactie te laten verlopen en dus ook hoe langzamer de stoffen zullen reageren.
Eenmaal de drempelwaarde is bereikt is daalt de lijn verder naar beneden dan de startpositie dat kenmerkend is voor een exotherme reactie. De producten hebben namelijk een lagere energie. Het verschil in energie van de reactanten en producten is dan de energie dat overblijft en vrijkomt tijdens een reactie. Wanneer de reactie endotherm is dan is het verschil tussen de reactanten en producten juist de energie dat wordt opgenomen.
Test je kennis
De grafiek hoeft niet precies overeen te komen. Zolang het maar aan het volgende voldoet. - De reactanten staan links en de producten staan rechts. - Assenvermelding: energie op de verticale as en verloop van de reactie op de horizontale as. - De positie op de verticale as (energie) van de producten is hoger dan die van de reactanten.
Dat er meer energie in deze bindingen is opgeslagen en dus meer energie vrijkomt wanneer deze bindingen breken.
Wanneer een binding breekt worden de elektronen die een binding worden opgesplitst. Deze elektronen kunnen weer worden gebruikt om een binding te vormen met een ander deeltje. In een chemische reactie worden dus elektronen afgestaan en opgenomen om bindingen te vormen of te verbreken.
